
 |
Dalla teoria cinetica dei gas risulta evidente che le particelle che compongono una sostanza posseggono un' energia cinetica. Inoltre esse possiedono una energia potenziale, che è in relazione con le forze che agiscono tra glia atomi che costituiscono le molecole. La somma delle varie forme di energia molecolari è detta energia interna della sostanza o più semplicemente calore. L' energia interna cresce al crescere della temperatura e decresce al decrescere della temperatura. Dal punto di vista molecolare l' energia interna delle molecole dipende dal numero di atomi che compongono le molecole stesse. Nel caso di un gas perfetto monoatomico, un atomo avrà tre gradi di libertà ( può muoversi in tre direzioni), mentre un biatomico avrà 5 gradi di libertà potendo anche ruotare attorno a un centro di massa ideale.

Possiamo quindi differenziare l'energia interna U nel caso dei gas perfetti nei seguenti modi:

dove R=8.315 J/(mol·K) è la costante universale dei
gas, e n il numero di moli.
E' noto che il calore fluisce spontaneamente da un oggetto a temperatura più
alta ad uno a temperatura più bassa. E' questo il motivo per cui un oggetto
bollente è molto caldo al tatto. In questi termini possiamo dare una definizione
più appropriata di calore:
Il calore è l' energia che si trasmette da un corpo a temperatura più alta,
a un corpo a temperatura più basa, in virtù della differenza fra le temperature.
Quindi la quantità di calore Q è direttamente proporzionale alla variazione
della temperatura e anche alla massa. Queste due proporzionalità dirette sono
espresse per mezzo di una costante di proporzionalità c detta calore
specifico dall' equazione:
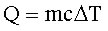
il calore specifico varia in base alle sostanze.

Un' unita di misura molto utilizzata
per il calore è la caloria: 1 cal è la quantità di calore che
fa salire la temperatura di 1 g di acqua da 14.5 °C a 15.5 °C. In realtà però
l' unità di misura del calore SI è il joule, che è l' equivalente
meccanico della caloria:
1 cal = 4.186J
Per saperne di più consulta i seguenti approfondimenti:
Tutto quanto riportato in questa pagina è a puro scopo informativo personale. Se non ti trovi in accordo con quanto riportato nella pagina, vuoi fare delle precisazioni, vuoi fare delle aggiunte o hai delle proposte e dei consigli da dare, puoi farlo mandando un email. Ogni indicazione è fondamentale per la continua crescita del sito.